你應該要知道的食事
許多民眾都非常關心新冠疫苗的發展進度,以及向國外採購的可能性。除此之外,對於縮短新冠疫苗的研發週期,也有許多人存疑,是否具有足夠的安全監控?針對這一連串從產品開發到上市後監控,食藥署已積極投入並佈局,致力讓未來新冠疫苗達到良好的品質與用藥安全。
口述=吳秀梅(衛生福利部食品藥物管理署署長)
採訪‧撰文=編輯部
面對全球新冠肺炎持續擴散,各國確診病例與死亡人數不斷攀升,儘管台灣疫情控制得當,但基於地球村的觀念,全球關係息息相關,積極研發疫苗也成為台灣刻不容緩的作為與使命。
縮短疫苗研發期程的具體作法
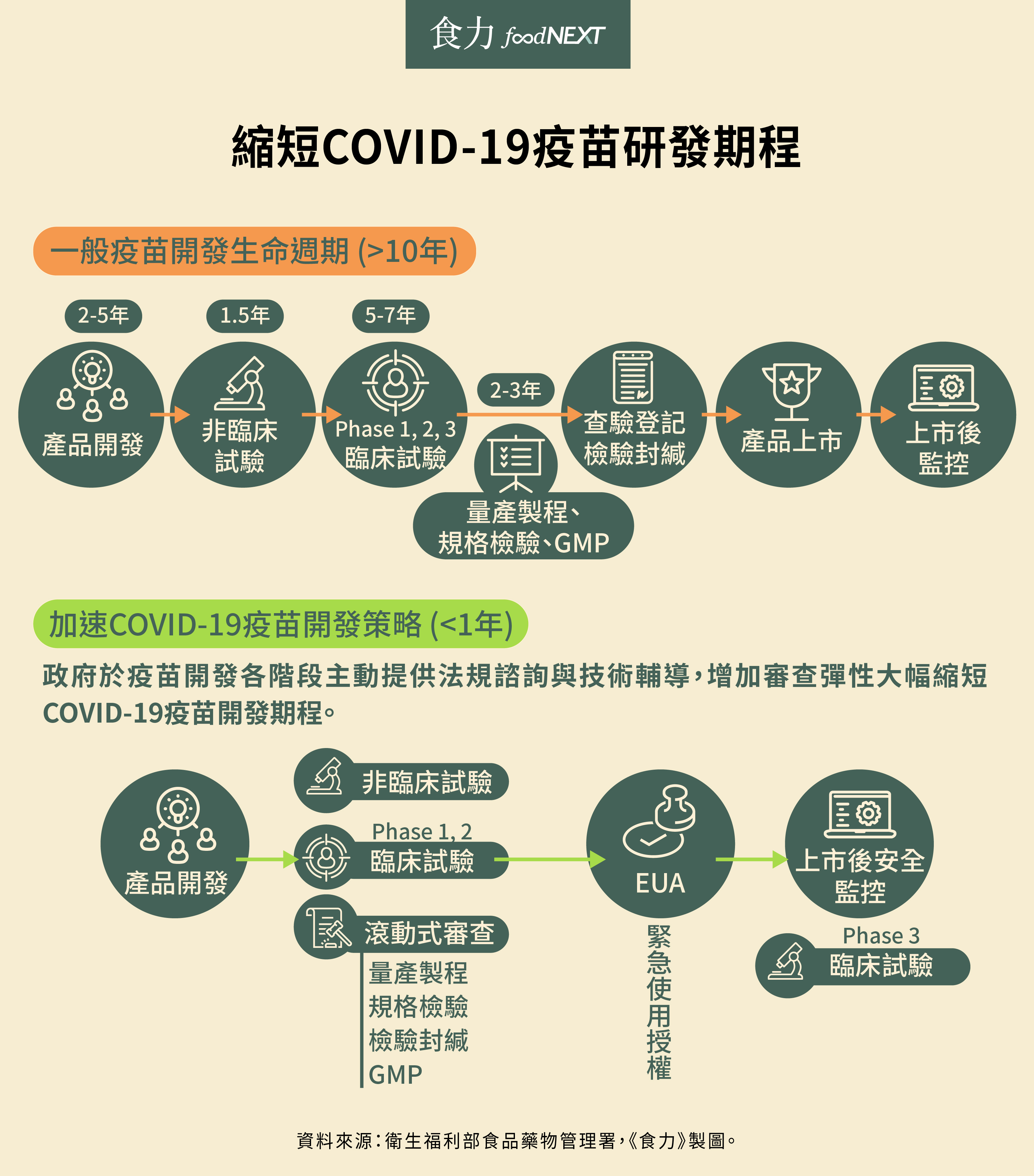
一個藥品的研發到底需要多久?食藥署署長吳秀梅表示,從產品開發到上市後監控,稱之「藥品開發生命週期」,在這個週期中,必須歷經產品開發(約2~5年)、非臨床試驗(又稱動物試驗,約1~2年)、臨床試驗(分為第一、二、三期,約5-7年)、查驗登記(包含量產製程、規格檢驗、GMP、檢驗封緘,約2~3年),直到產品上市,需要超過10年歷程。
為了滿足防疫需求,食藥署與製造業者、學研單位與專家進行溝通,規劃新冠疫苗最快最適切的研發時程,為了讓法規流程加快、同時確保疫苗品質,採取各階段平行執行的策略,且進行滾動式審查,藉以加速疫苗開發流程。
目前國內已獲得經費支持的共有三家廠商,包括國光生技、高端疫苗及聯亞生技。這三家公司所開發的疫苗均為次單位重組蛋白疫苗,且已展開第一期的臨床試驗。吳秀梅指出:「假如第二期的臨床試驗進度順利,我們不排除以EUA(緊急使用授權)方式加速國內疫苗上市,然而,這是因應疫情採取的緊急途徑,緊急情況終止後,如果產品想要在市場上銷售,還是要遵循一般上市途徑。」
各院署與專家,傾力協助
為了加速新冠疫苗研發量產,食藥署也與財團法人醫藥品查驗中心組成專案諮詢輔導團隊,每週與廠商進行會議,提供技術性輔導。此外,國衛院與中研院提供技術支援、醫事司與醫福會協助加速臨床試驗行政程序、疾管署提供經費補助、食藥署駐廠監製,並協助檢驗方法開發等,跨單位合作全力協助疫苗開發。
為了加速疫苗研發進程,食藥署也召開多次專家會議,像是針對第二期疫苗臨床試驗,研訂疫苗受試者人數須達到3,000人,並加上安慰劑組500人,這已超過傳統第二期臨床試驗要求的人數。吳秀梅說明:「針對人數與追蹤時間,我國採用與美國相同的標準,所以對第二期臨床試驗來說,要求的受試者人數較多,負擔也很重,但是受試者多,可以看見更多不常見的副作用,未來疫苗的使用對民眾來說會更加安全。」
國外採購疫苗的積極作法
因應新冠肺炎防疫需求,政府也積極向國際藥廠洽購疫苗。針對國內研發疫苗及國外採購的疫苗,都需申請專案製造或輸入以供緊急使用(EUA),申請者仍須依規定檢附資料供審。另外,只要資料齊備,也可以選擇申請國產或輸入藥品查驗登記,取得正式上市許可。
至於國產或進口疫苗對身體保護力,吳秀梅說明:「疫苗的原理就是利用新冠病毒蛋白為抗原,讓身體認識這個病毒,產生可對應的抗體和免疫反應。」她也說明臨床試驗中,評估疫苗保護力的計算方式:
舉例來說,倘若施打疫苗組為3,000人,有25人感染新冠病毒,感染率為0.84%。
另外,安慰劑(對照)組500人中,有75人感染新冠病毒,感染率為15%。
所以,疫苗的保護力就是(15-0.84)/15=0.94,亦即94%的保護力。
為了加速推動疫苗研發,目前食藥署已建立「COVID-19疫苗臨床試驗意向登記平台」,提供有意願參與臨床試驗的民眾上網登記,登記人數已達2萬人以上,藉由國人的共同努力,共同邁向國產疫苗「國產國用」、「自助助人」的積極目標。
【食品藥物管理署廣告】
延伸閱讀
▶食藥署署長:《醫材法》助台灣接軌國際 創造多贏局面
▶吃藥為了救命,吃錯就會害命!食藥署署長教你如何安全用藥
▶化粧品新法上路讓臺灣接軌國際、消費者保護更升級